Abstrait
Importance: Les tissus biologiques sont typiquement caractérisés par une forte diffusion anisotrope et peuvent également présenter une biréfringence de forme linéaire. La diffusion et la biréfringence polarisent le déphasage entre les composantes du champ électrique transversal de la lumière polarisée. Ces altérations de phase sont associées à des malformations structurelles particulières du tissu. En fait, la majorité des techniques basées sur la polarisation sont incapables de distinguer la nature du déphasage induit par la biréfringence ou la diffusion de la lumière.
Objectif: Nous explorons les contributions distinctes de la diffusion et de la biréfringence dans le retard de phase de la lumière polarisée circulairement propagée dans un milieu de diffusion de type tissu trouble.
Approche: La lumière polarisée circulairement dans le cadre de l’approche polarimétrique de Stokes est utilisée pour le criblage de fantômes biotissus et d’échantillons de peau de poulet. Le changement des propriétés optiques de la peau de poulet est réalisé par compensation optique, qui réduit la diffusion, et étirement mécanique, qui induit la biréfringence. Le changement des propriétés optiques du tissu cutané est confirmé par des mesures spectrophotométriques et une imagerie de deuxième génération harmonique.
Résultats: Les contributions de la diffusion et de la biréfringence dans le retard de phase de la lumière polarisée circulairement propagée dans les tissus biologiques se distinguent par le locus du vecteur de Stokes cartographié sur la sphère de Poincaré. Le retard de phase de la lumière polarisée circulairement dû à des altérations de diffusion est évalué. La valeur de la biréfringence dans la peau de poulet est estimée à 0,3 × 10 – 3 , qui est en accord avec des études alternatives. Le changement de biréfringence du tissu cutané dû à l’étirement mécanique de l’ordre de 10 – 6 est détecté.
Conclusions: Si les paramètres polarimétriques à eux seuls ne permettent pas de distinguer les contributions de diffusion et de biréfringence, la trajectoire résultante du vecteur de Stokes sur la sphère de Poincaré révèle le rôle de la diffusion et de la biréfringence dans le retard de phase total. L’approche décrite, appliquée indépendamment ou en combinaison avec la polarimétrie Mueller, peut être bénéfique pour la caractérisation avancée de divers types de malformations dans les tissus biologiques.
1.
introduction
L’utilisation de la lumière polarisée dans diverses applications biomédicales se développe rapidement ces dernières années.1 Les avantages des modalités de diagnostic basées sur la polarisation par rapport aux techniques optiques conventionnelles, ainsi que les caractéristiques et les défis de la caractérisation des tissus biologiques à l’aide de ce que l’on appelle l’empreinte de polarisation optique, sont largement décrits ailleurs.2 – 5 En raison de ses propriétés uniques, la lumière polarisée est largement utilisée comme complément considérable à un certain nombre de techniques conventionnelles de diagnostic et d’imagerie. Cet ajout fournit des informations précieuses sur la structure morphologique d’un biotissus. Les exemples sont la tomographie par cohérence optique sensible à la polarisation, 6 imagerie hyperspectrale sensible à la polarisation, sept polarimétrie de deuxième génération harmonique (SHG), 8 microscopie sensible à la polarisation, 9 et d’autres.
Le formalisme vectoriel de Jones basé sur le champ et le calcul de Stokes – Mueller basé sur l’intensité sont les deux principales approches mathématiques qui définissent l’état de polarisation de la lumière et décrivent l’interaction de la lumière polarisée avec les médias.dix Un certain nombre de modalités innovantes basées sur la polarisation ont été développées pour diverses applications biomédicales, en utilisant des paramètres de Stokes – Mueller physiquement mesurables, par exemple la polarimétrie à matrice de Mueller.11 – 14 Cette approche permet d’obtenir une matrice de Mueller 4 × 4 complète de l’échantillon qui contient des informations polarimétriques complètes de l’échantillon examiné. La polarimétrie à matrice de Mueller montre des résultats prometteurs, en particulier dans le dépistage des tissus cancéreux15 – 18 et la caractérisation d’autres milieux de diffusion de type tissu trouble.19 – 21 De plus, il a été démontré que l’utilisation de la lumière à polarisation circulaire dans le cadre de l’approche de polarimétrie vectorielle de Stokes, complétée par l’utilisation de la sphère de Poincaré comme outil graphique quantitatif, a un potentiel élevé pour la caractérisation tissulaire et l’évaluation de l’agressivité du cancer.22 – 27
En termes de propriétés optiques, outre l’absorption, les tissus biologiques sont caractérisés par une diffusion (typiquement, de l’ordre de quelques dizaines de mm-1 pour la lumière visible) et une forte anisotropie de diffusion (g≈0,8).28 En plus de la diffusion de la lumière, due à la structure fibreuse hétérogène, les tissus biologiques présentent souvent une biréfringence de forme linéaire, qui est une quantité mesurable; ses changements peuvent agir comme une métrique pour certaines anomalies structurelles des tissus biologiques.29 En fait, à la fois la diffusion et la biréfringence peuvent élaborer un déphasage entre les composantes du champ électrique du vecteur champ de la lumière polarisée lors de sa propagation dans le milieu biologique. Exemples de tels tissus, cartilage 30 ou tendon, 31 présentent une biréfringence de forme suffisante en raison de structures ordonnées linéairement, 4 et les anomalies de la structure peuvent être détectées assez facilement. Au contraire, les fibres de collagène de la peau sont caractérisées par une orientation arbitraire, 32 , 33 ce qui rend la contribution de la biréfringence au déphasage entre les composantes du champ électrique de la lumière polarisée très mineure par rapport à la diffusion. Cela pose un défi pour distinguer la biréfringence dans la peau et analyser ses changements dus à d’éventuelles anomalies structurelles du tissu. Ainsi, dans le cadre de la polarimétrie à matrice de Mueller, il n’est pas possible de distinguer le déphasage entre les composantes de champ électrique transverse se produisant en raison de la biréfringence de celle se produisant en raison de la diffusion de la lumière. Le but de la présente étude est d’explorer comment les variations de la biréfringence et de la diffusion contribuent au retard de phase global de la lumière polarisée circulairement propagée dans un milieu de diffusion de type tissu trouble, tel que la peau. Nous appliquons la polarimétrie laser à vecteur de Stokes avec un éclairage à polarisation circulaire, 22 qui est une approche robuste et plus rentable pour la caractérisation tissulaire que la polarimétrie à matrice de Mueller. Cette approche d’imagerie par balayage laser assure un meilleur contrôle de la localisation de la lumière dans l’échantillon de tissu. Les avantages de la lumière polarisée circulairement incluent la conscience directionnelle, 34 – 37 c’est-à-dire le basculement de l’hélicité en cas de rétrodiffusion et la préservation de l’hélicité pour la diffusion vers l’avant. Ce phénomène, connu sous le nom de mémoire de polarisation de la lumière polarisée circulairement, 34 , 35 , 38 est d’une importance fondamentale. La polarisation linéaire ne possède pas un tel sens de la direction dans laquelle la lumière se déplace.
Afin d’étudier systématiquement les altérations du déphasage entre les composants transversaux de la lumière polarisée circulairement en raison de la diffusion et de la biréfringence, nous utilisons à la fois les fantômes de tissus biologiques fabriqués en interne et des échantillons de tissus. La peau de poulet a été choisie comme exemple de tissu biologique en raison de la présence à la fois de la forme et de la biréfringence intrinsèque inhérente au collagène. 39 , 40 ainsi que la diffusion.
2.
Méthodes et matériel
2.1.
Système expérimental
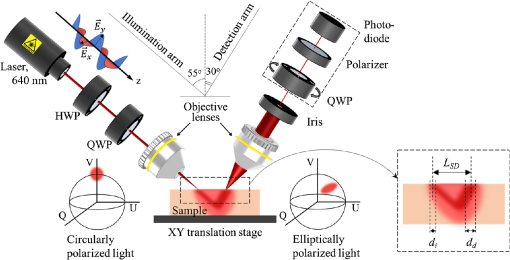
Dans le système expérimental ( Fig. 1 ) développée en interne, la lumière polarisée linéairement produite par une source laser (640 nm, Edmund Optics) a été modifiée par des plaques demi-onde et quart d’onde dans la polarisation circulaire droite. La lumière polarisée circulaire de droite a été focalisée avec une lentille d’objectif sur l’échantillon à un angle de 55 degrés. L’échantillon a été placé au stade de la traduction X – Y. La lumière rétrodiffusée a été collectée avec une lentille d’objectif à un angle de 30 degrés à une distance variable du LSD du point d’incidence, vignettée par un iris de 100 μm et son état de polarisation a été analysé par le polarimètre à vecteur de Stokes (Thorlabs), qui se composait d’une plaque quart d’onde rotative, d’un polariseur et d’un wattmètre. Le diamètre du faisceau laser focalisé incident di était d’environ 15 μm [mesuré avec un profileur de faisceau laser (BeamMaster BM-7, Coherent)]. Le champ de vision de l’objectif dans le bras de détection dd était de 50 μm. Les vecteurs de Stokes mesurés ont été analysés en utilisant la sphère de Poincaré comme outil graphique.22 , 26 , 27 , 41 Dans Fig. 1 , deux sphères de Poincaré montrent respectivement la position du vecteur de Stokes de la lumière incidente à polarisation circulaire droite (sphère à gauche) et ses changements relatifs lors de l’interaction avec le milieu / échantillon de tissu (sphère à droite). Le système expérimental décrit a été largement utilisé dans des études antérieures. 22 , 23 , 25
2.2.
Protocoles expérimentaux
Afin d’explorer les contributions de la diffusion et de la biréfringence au retard de phase de la lumière polarisée de manière circulaire, une série d’expériences avec des fantômes imitant les biotissus et des tissus biologiques a été réalisée.
2.2.1.
Expériences de modèle
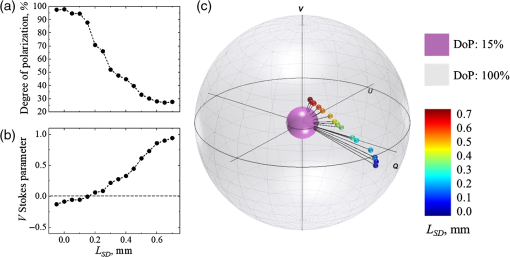
Variation de la séparation source-détecteur . Afin de confirmer l’impact de la séparation source-détecteur LSD sur l’état de polarisation de la lumière diffusée à partir d’un milieu de diffusion de type tissu trouble, une expérience avec variation de la séparation source-détecteur a été réalisée en utilisant un fantôme tissulaire. L’état de polarisation de la lumière diffusée par le fantôme (μs = 6 mm − 1, g≈0,8 et épaisseur = 8 mm) a été mesuré avec différentes séparations source-détecteur (−0,05 mm ≤ LSD ≤ 0,7 mm). La valeur du LSD a été mesurée à partir du point zéro estimé, qui était le lieu de coïncidence des points focaux des bras d’éclairage et de détection, qui correspondait à l’intensité la plus élevée sur le détecteur. Le point de coïncidence a été défini comme LSD = 0; la poursuite de la convergence de la source et du détecteur était considérée comme du LSD négatif, tandis que leur séparation était considérée comme du LSD positif.
Des fantômes imitant les tissus avec les propriétés optiques confirmées à certaines longueurs d’onde ont été fabriqués en interne à partir de plastisol de chlorure de polyvinyle (MF Manufacturing Co.), une solution grasse opaque blanche de monomères qui polymérise et devient transparente à haute température. Des particules de ZnO (Sigma-Aldrich, Allemagne) ont été utilisées pour imiter les propriétés de diffusion évaluées sur la base de la concentration et de la distribution de taille extraites de la microscopie électronique à balayage / transmission. La procédure de préparation a été décrite ailleurs. 42 , 43 Les fantômes fabriqués ont été stockés sur des lames de verre à température ambiante à l’abri de la lumière directe. Les propriétés de diffusion des fantômes tissulaires ont été confirmées avec les mesures standard de la transmittance collimatée, de la transmittance totale et de la réflectance totale 43 , 44 utilisant le système spectrophotométrique équipé de sphères d’intégration OL-750 (Optronic Laboratories) dans le domaine spectral de 600 à 700 nm. L’épaisseur des échantillons a été mesurée avec le tomographe à cohérence optique (Hyperion, Thorlabs), tandis que l’indice de réfraction a été estimé avec le réfractomètre Abbe (DR-M2 1550, Atago, Japon).
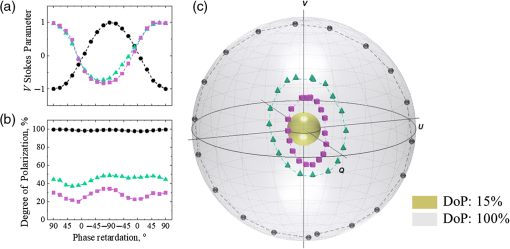
Modification de la phase de la lumière à polarisation circulaire due à la diffusion et à la biréfringence . Dans les expériences de modèle, le changement de diffusion a été obtenu en utilisant des fantômes tissulaires avec différents coefficients de diffusion (μs = 4 et 8 mm − 1, g≈0,8, épaisseur = 1 mm), tandis que l’altération de phase due à la biréfringence a été imitée en ajoutant un déphasage variable en éclairage incident utilisant la lame demi-onde (voir Fig. 1 ). Des expériences ont été réalisées avec du LSD = 1,5 mm. Afin de mettre en évidence les altérations de phase dues à la biréfringence en l’absence de diffusion, une expérience simple avec un miroir utilisé comme échantillon a été réalisée (LSD = 0 mm et μs = 0 mm − 1; les angles d’incidence et de détection ont été modifiés afin de détecter la réflexion du miroir).
2.2.2.
Distinguer la diffusion et la biréfringence dans les altérations de phase en utilisant la peau de poulet
Afin de différencier les contributions de diffusion et de biréfringence dans le retard de phase de la lumière polarisée propagée à travers la peau du poulet, la compensation optique 45 , 46 a été utilisé pour supprimer la diffusion, tandis que la biréfringence était induite par étirement mécanique. Une mesure séparée des propriétés de diffusion du tissu de peau de poulet avec et sans compensation a été réalisée en utilisant le système spectrophotométrique, comme décrit dans la Sec. 2.2.1 . La clarification optique a été réalisée en appliquant une solution de glycérol à 40% dans l’eau pendant 1 h. L’alignement des fibres de collagène dans la peau de poulet optiquement nettoyée à la suite d’un étirement mécanique a été validé séparément par l’imagerie SHG en utilisant un microscope multiphotonique standard (A1R MP +, Nikon). L’imagerie a été réalisée à l’aide d’un objectif CFI Plan Apochromat 10 × G Glyc (corrigé pour l’eau et le glycérol) immergé dans une solution à 40% de glycérol-eau sans verre de protection.
Sur la base des résultats acquis dans les expériences modèles et l’imagerie SHG des fibres de collagène dans la peau de poulet, des expériences en trois étapes avec des échantillons de peau de poulet ont été réalisées. L’échantillon de peau de poulet (taille ~ 2,5 x 6,5 cm2) a été excisé d’une cuisse de poulet et placé sur un porte-échantillon avec la face interne de la peau vers le haut. Pour exclure la diffusion sur la rugosité de la peau et les contaminations de surface causées par des flocons et / ou des fractions de follicules de plumes résiduelles, les échantillons de peau de poulet ont été mesurés à partir de la face interne. Le balayage spatial de l’échantillon de tissu a été réalisé à la surface de 2 x 2 mm2 avec un pas de 200 μm. La mesure à chaque point de balayage était une moyenne de 10 mesures. Au premier stade, l’échantillon a été laissé intact pendant 30 min dans des conditions normales pour réduire le niveau d’humidité à la surface de l’échantillon fraîchement excisé. En outre, l’agent de clarification optique (solution de glycérol-eau à 40%) a été appliqué localement à la surface de l’échantillon. Après 60 min de compensation optique, l’étirement mécanique (jusqu’à 1,5 N) a été progressivement appliqué à l’échantillon optiquement nettoyé le long du plan d’incidence de la lumière. L’étirement mécanique a été appliqué à l’extrémité courte de l’échantillon en utilisant la force gravitationnelle et un système de poulies. Aucun alignement supplémentaire de l’échantillon n’a été effectué pendant l’expérience afin d’enregistrer le changement de polarisation en temps réel au cours des trois étapes de l’expérience sans aucune influence externe. Les mesures ont été effectuées toutes les 5 min; les vecteurs de Stokes mesurés ont été moyennés sur toute la zone de balayage et leurs changements dans le temps ont été analysés.
3.
Résultats et discussion
3.1.
Expériences sur modèle: variation de la séparation source-détecteur
Dans l’expérience avec la variation de la séparation source-détecteur, LSD, les vecteurs Stokes de lumière diffusée à partir d’un fantôme tissulaire ont été mesurés à différents LSD. Les résultats de l’expérience sont présentés dans Fig. 2 : (a) degré de polarisation (DoP), (b) paramètre V Stokes, (c) Les vecteurs de Stokes cartographiés sur la sphère de Poincaré par rapport à la DoP. Dans le panneau (c), les rayons des sphères externe (grise) et interne (violette) correspondent respectivement à 100% et 15%. La polarisation de la lumière incidente, 100% circulaire droite (vecteur de Stokes[1;0;0;1] ), est situé au pôle nord à la surface de la sphère extérieure de Poincaré. Les lignes noires reliant l’origine aux pointes des vecteurs de Stokes correspondent à la DoP. Vidéo 1 (mp4, 4 Mo) montre la sphère de Poincaré tournant autour de l’axe V pour une meilleure compréhension des positions des pointes des vecteurs de Stokes à l’intérieur de la sphère de Poincaré.
3.2.
Expériences sur modèle: altérations de phase dues à la diffusion et à la biréfringence
Afin d’explorer les altérations de la phase de la lumière polarisée circulairement dues aux changements de diffusion et de biréfringence, des expériences avec un miroir (pas de diffusion) et deux fantômes de diffusion ont été réalisées. L’état de polarisation de la lumière réfléchie par le miroir et rétrodiffusée par les fantômes avec différents coefficients de diffusion (μs = 4 et 8 mm − 1) est indiqué dans Fig. 3 : (a) paramètre V Stokes, (b) DoP, et (c) Les vecteurs de Stokes cartographiés sur la sphère de Poincaré par rapport à la DoP. La polarisation de la lumière incidente, circulaire droite, correspond au pôle nord de la sphère de Poincaré et à un retard de phase de 90 degrés entre les composantes de polarisation orthogonales. Vidéo 2 (mp4, 4 Mo) montre la sphère de Poincaré du panneau (c) tournant autour de l’axe V Stokes pour une meilleure compréhension de l’emplacement des vecteurs de Stokes à l’intérieur de la sphère de Poincaré.
3.3.
Contributions de la dispersion et de la biréfringence dans les altérations de phase observées dans la peau de poulet
Dans les expériences avec la peau de poulet, la diffusion a été réduite par compensation optique, tandis que la biréfringence de forme a été induite en appliquant un étirement mécanique à l’échantillon de peau de poulet. Une mesure indépendante des propriétés optiques des tissus de peau de poulet avec et sans compensation optique à l’aide d’un système spectrophotométrique43 , 44 a montré qu’après compensation optique, le coefficient de diffusion de la peau de poulet μs a diminué de 30% (de 13 à 9 mm-1), alors que le facteur d’anisotropie g a augmenté de 18% (de 0,8 à 0,95).
L’alignement des fibres de collagène dans un échantillon de peau de poulet optiquement nettoyé en raison de l’étirement mécanique a été validé à l’aide de l’imagerie SHG. Graphique 4 illustre l’imagerie SHG de fibres de collagène à peu près de la même zone de l’échantillon influencée par différents degrés d’étirement: (a) pas d’étirement, (b) une force d’étirement de 0,74 N, et (c) force d’étirement de 1,35 N.Comme on peut le voir dans Figure. 4 a), le faisceau de collagène sans aucun étirement appliqué a été dispersé; cependant, après 0,74 N d’étirement, il est devenu plus aligné et le signal SHG est devenu plus lumineux [voir Figure. 4 b)]; après 1,35 N d’étirement, cette tendance est devenue plus importante [voir Figure. 4 c)]. Le contraste plus élevé des fibres à des degrés d’étirement plus élevés dans les images SHG est en corrélation avec le signal SHG plus fort et indique en outre un alignement plus élevé des fibres. La direction de l’alignement des fibres coïncidait avec la direction de la force d’étirement appliquée.
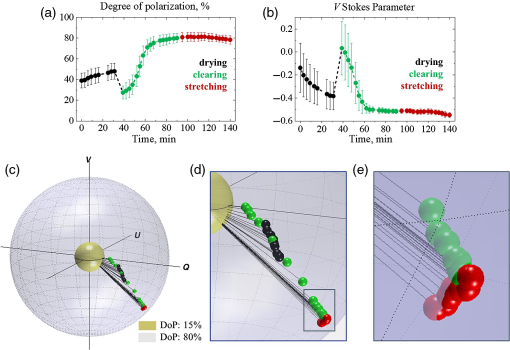
Suite aux résultats des expériences sur modèles et des mesures spectrophotométriques et SHG de la peau de poulet, les expériences en trois étapes avec des échantillons de peau de poulet ont été réalisées. Les altérations de l’état de polarisation de la lumière propagée au sein de l’échantillon de peau de poulet conservée dans des conditions normales pendant 30 min (séchage) et influencées par la compensation optique pendant 1 h et l’étirement mécanique (jusqu’à 1,5 N) sont présentées dans Fig. 5 . Panneaux (a) et (b) montrer les modifications des paramètres DoP et V Stokes dans le temps; panneau (c) illustre la trajectoire du vecteur de Stokes mesuré cartographié sur la sphère de Poincaré: les sphères interne (jaune) et externe (bleue) correspondent à 15% et 80% de DoP, respectivement; panneau (d) montre une vue agrandie de la piste vectorielle de Stokes mappée sur la sphère de Poincaré; panneau (e) montre de près les points de données qui correspondent à l’étirement. Chacun des points de données correspond à la valeur de la composante vectorielle de Stokes moyennée sur la zone de balayage (2 × 2 mm2, pas de 200 µm, 10 mesures à chaque pas) et les barres d’erreur représentent l’écart type. Pour plus de détails sur les composantes vectorielles Q et U Stokes, reportez-vous à la Fig. S1 dans le Matériel supplémentaire .
Suite aux résultats d’expériences avec variation de la séparation source-détecteur (Sec. 3.1 ), le LSD a été fixé à 0,3 mm, car il s’agissait de la plus grande valeur de séparation qui fournissait une DoP suffisante (au moins 40%). Une DoP suffisante au début de l’expérience était nécessaire car le protocole expérimental ne permettait aucun alignement supplémentaire de l’échantillon pendant les mesures afin d’enregistrer le changement de polarisation en temps réel sans aucune influence externe. Les modifications du vecteur de Stokes alors que la DoP était inférieure à 20% n’ont pas été considérées comme fiables.
Comme on peut le voir dans Figure. 5 a), la DoP était d’environ 40% au début de l’expérience. Le processus de séchage a provoqué une croissance de la DoP jusqu’à 50%, ce qui était probablement dû à la réduction de la dispersion de l’échantillon de tissu en raison de son rétrécissement.51 Une fois que l’agent de compensation optique a été appliqué localement sur le tissu cutané, la DoP a chuté de manière significative en raison de l’adaptation de l’indice de réfraction à la surface du milieu et de l’activation de l’impact des photons avec des longueurs de trajet plus longues dans le tissu au signal mesuré.52 En outre, pendant la compensation optique, la DoP a augmenté de façon exponentielle jusqu’à 80% jusqu’à ce qu’elle cesse de changer à la 80e minute de l’expérience. L’application ultérieure de l’étirement mécanique n’a pas causé de changement suffisant dans la DoP, ce qui est en corrélation avec les résultats des expériences sur modèle (Sec. 3.2 ), car l’étirement mécanique a changé principalement de biréfringence sur fond de diffusion supprimée.
Les modifications du paramètre V Stokes sont affichées dans Figure. 5 b). Comme on peut le voir, au début des mesures, l’état de polarisation de la lumière à diffusion multiple était proche de linéaire, ce qui signifie que les parties détectées de la lumière avec des hélicités gauche et droite étaient presque égales. Le processus de séchage a conduit à la décroissance régulière du paramètre V Stokes, suivie d’un saut au moment où l’agent de compensation optique a été appliqué. La diffusion de l’agent de compensation optique dans le tissu cutané a entraîné une réduction de la diffusion avec la décroissance exponentielle du paramètre V Stokes jusqu’à ce qu’il devienne asymptotique à la 80e minute de l’expérience. L’étirement mécanique a conduit à l’altération de la biréfringence dans l’échantillon, qui s’est manifestée par le renouvellement de la décroissance du paramètre V Stokes [Figues. 5 c)– 5 e) ]. Ceci est en corrélation avec les traces vectorielles de Stokes observées dans les expériences sur modèle (Sec. 3.2 ) à plus petite échelle, car la biréfringence de l’échantillon est mineure.
L’altération du paramètre V Stokes dans la troisième étape de l’expérience a été causée par le fait que l’étirement mécanique alignait initialement les fibres de collagène dispersées dans une direction majeure, induisant une biréfringence de forme. La structure orientée linéairement des fibres de collagène dans la peau pourrait être considérée comme un système de longs cylindres diélectriques caractérisé par la différence d’indice de réfraction effectif (Δn) pour la lumière polarisée le long et perpendiculaire aux cylindres du modèle.4 Cela indique que la biréfringence induite par l’étirement mécanique a influencé l’état de polarisation de la lumière diffusée à partir de l’échantillon de tissu. La polarisation de la lumière incidente étant circulaire, elle contenait les parties égales de la lumière polarisée dans des directions parallèles et perpendiculaires par rapport à l’axe optique de la structure des fibres de collagène. Le retard de l’une de ces composantes de polarisation a influencé l’ellipticité de la polarisation résultante, ce qui a changé la valeur de la composante vectorielle VStokes.
Bien que dans les graphiques 2D Figues. 5 a) et 5 b) , les modifications dues à l’étirement mécanique n’apparaissent pas significatives, la cartographie du vecteur de Stokes sur la sphère de Poincaré permet d’identifier la nature de ces modifications [Figues. 5 c)– 5 e) ] et en les distinguant des changements du vecteur de Stokes dus à la variation de la diffusion. Ainsi, les altérations du vecteur de Stokes associées au séchage et à la compensation optique du biotissus se manifestent par un décalage vers le bas sur la sphère de Poincaré accompagné de l’augmentation de la magnitude du vecteur de Stokes due aux changements simultanés du paramètre V Stokes et de la DoP [Figues. 5 c) et 5 d) ], tandis que l’altération du vecteur de Stokes due au changement de biréfringence est observée comme un déplacement à la surface de la sphère de Poincaré avec la magnitude du vecteur préservée [voir Figure. 5 e)]. Comme on peut le voir, les points de données rouges appartiennent à la surface de la même sphère, tandis que la direction des altérations de l’état de polarisation dues au dégagement optique (vers le bas et vers la surface de la sphère externe) est suffisamment différente de celle due à l’étirement [ le long du rayon de la sphère extérieure, voir Figure. 5 e)]. Ces résultats concordent bien avec les résultats des expériences sur modèle de Sec. 3.2 .
Les résultats obtenus montrent que la phase relative δ entre deux composantes de polarisation orthogonale du champ électrique de la lumière incidente polarisée circulairement a changé d’environ 30% à la suite du séchage, en 4,5 fois en raison de la compensation optique et de 1,3% en raison de la mécanique étendue. Les changements du retard de phase pendant le séchage et la compensation optique sont attribués à la variation de diffusion. La diffusion étant significativement réduite par la compensation optique, l’application de l’étirement mécanique a conduit au retard de phase associé notamment à la biréfringence induite dans l’échantillon. Selon les résultats obtenus, la biréfringence (Δn = δλ / 2πl, où λ est la longueur d’onde et l est la longueur de trajet des photons dans le tissu jusqu’à 1 mm 53 ) pour l’échantillon de peau de poulet est estimée à 0,3 × 10−3. Le résultat s’accorde bien avec les résultats d’études alternatives. 4 La variation globale de la valeur de la biréfringence pendant l’étirement mécanique (| Δn1 − Δn2 | = Δδ⋅λ / 2πl, où Δδ est la variation de la phase relative) est estimée à 3,7 × 10−6. En fait, l’impact de la diffusion sur la DoP et l’altération de phase prévaut de manière significative sur le déphasage dû à la biréfringence. Par conséquent, il est presque impossible d’observer les changements de phase dus à la biréfringence de la peau dans des conditions normales. Dans notre cas, avec une réduction de la diffusion par compensation optique et une amélioration de la biréfringence par étirement, nous avons pu les observer et les évaluer.
Ainsi, les changements de direction du paramètre V Stokes et DoP [voir Figues. 5 a) et 5 b) ] sont associés, respectivement, aux changements d’anisotropie de diffusion de la lumière polarisée circulairement et aux changements de diffusion et de réflexion interne totale sur la limite du milieu dus à la compensation optique. L’impact de la diffusion sur la lumière à polarisation circulaire a été largement étudié et évalué plus tôt.22 – 24 , 54 , 55 Alors que le paramètre V Stokes et la DoP n’apportent pas à eux seuls d’informations notables en termes de contributions distinctives de la diffusion et de la biréfringence, la trajectoire résultante du vecteur de Stokes sur la sphère de Poincaré [voir Figure. 5 c)] permet de révéler le rôle à la fois de la diffusion et de la biréfringence dans le retard de phase total.
4.
Résumé et conclusions
L’étude se concentre sur l’évaluation des contributions isolées de la diffusion et de la biréfringence dans le retard de phase global de la lumière polarisée circulairement propagée à travers le milieu de diffusion tissulaire. À l’aide des expériences modèles utilisant des fantômes tissulaires, l’influence de la séparation source-détecteur sur la réponse polarimétrique du milieu a été démontrée. De plus, l’altération de la phase de la lumière polarisée circulairement due à la diffusion et à la biréfringence a été illustrée à l’aide de fantômes de tissu et de tissu de peau de poulet. Dans les expériences avec la peau de poulet, il a été constaté que le retard de phase entre deux composantes orthogonales du champ électrique de la lumière polarisée circulairement associée à des altérations de diffusion a changé d’environ 30% pendant 30 min de séchage et en 4,5 fois pendant 1 h optique clarification avec l’utilisation d’une solution à 40% de glycérol dans l’eau. Le retard de phase associé à l’altération de la biréfringence a changé de 1,3% lorsque l’étirement mécanique jusqu’à 1,5 N a été appliqué. La diminution de la diffusion tissulaire due à la compensation optique améliore la DoP jusqu’à 80%, ce qui permet de distinguer la biréfringence sur le fond de la diffusion restante. Ainsi, la biréfringence, induite par étirement mécanique, est observée comme le déplacement du vecteur de Stokes à la surface de la sphère de Poincaré, alors que la réduction de la diffusion se manifeste par la magnitude croissante du vecteur de Stokes, qui a été validée par des expériences sur modèle. La variation globale de la valeur de la biréfringence due à l’étirement mécanique est estimée à 3,7 × 10−6. La valeur de la biréfringence dans la peau de poulet est estimée à 0,3 × 10−3, ce qui correspond bien aux données connues de la littérature.4
Ainsi, les contributions isolées de la diffusion et de la biréfringence dans le retard de phase de la lumière polarisée circulairement propagée dans les tissus biologiques ont été démontrées à l’aide de fantômes imitant les tissus et de peau de poulet. in vitro avec application du dégagement optique et de l’étirement mécanique. L’alignement des fibres de collagène dans la peau de poulet en raison de l’étirement et, par conséquent, de l’induction de la biréfringence a été validé par l’imagerie SHG. La sphère de Poincaré est suggérée pour être utilisée comme outil graphique pour observer les trajectoires du vecteur de Stokes pour la caractérisation fonctionnelle (qualitative) et quantitative ultérieure des tissus biologiques et du milieu de diffusion de type tissu trouble. L’approche décrite peut être bénéfique pour la caractérisation plus avancée de divers types de malformations dans les tissus biologiques, par exemple, basée sur une combinaison de polarimétrie Stokes-vecteur et Mueller-matrice. Cela permettrait une évaluation quantitative fonctionnelle des éléments de la matrice de Mueller dépendant de la phase et leur interprétation en termes de retard de phase entre les composantes du champ électrique en raison de la diffusion et / ou de la biréfringence.
Divulgations
Les auteurs déclarent qu’il n’y a pas de conflits d’intérêts liés à cette étude.
Remerciements
Ce projet a reçu un financement du programme de recherche et d’innovation Horizon 2020 de l’Union européenne dans le cadre de la convention de subvention Marie Skłodowska-Curie no. 713606, le projet ATTRACT financé par la CE dans le cadre de la convention de subvention 777222, l’Académie de Finlande (subventions nos: 314369 et 325097), le financement stratégique INFOTECH, le projet d’excellence académique MEPhI (contrat n ° 02.a03.21.0005) et National Research Tomsk State Programme de fonds universitaires universitaires DI Mendeleev. Les auteurs remercient le professeur Valery Tuchin et le professeur Alex Vitkin pour leurs commentaires critiques et discussions utiles au stade de la préparation de l’article.
Références
1. T. Novikova et al., « Lumière polarisée pour applications biomédicales », J. Biomed. Opt., 21 (7), 071001 (2016). https://doi.org/10.1117/1.JBO.21.7.071001 JBOPFO 1083-3668 Google Scholar
2. N. Ghosh et AI Vitkin, « Polarimétrie tissulaire: concepts, défis, applications et perspectives », J. Biomed. Opt., 16 (11), 110801 (2011). https://doi.org/10.1117/1.3652896 JBOPFO 1083-3668 Google Scholar
3. VV Tuchin, « Interaction de la lumière polarisée avec les tissus », J. Biomed. Opt., 21 (7), 071114 (2016). https://doi.org/10.1117/1.JBO.21.7.071114 JBOPFO 1083-3668 Google Scholar
4. VV Tuchin, L. Wang et DA Zimnyakov, Polarisation optique dans les applications biomédicales, Springer Science & Business Media, Berlin, Heidelberg (2006). Google Scholar
5. R. Azzam, « Polarimétrie à vecteur de Stokes et à matrice de Mueller », J. Opt. Soc. Un m. A, 33 (7), 1396-1408 (2016). https://doi.org/10.1364/JOSAA.33.001396 JOAOD6 0740-3232 Google Scholar
6. JF De Boer, « Tomographie par cohérence optique sensible à la polarisation, , ”Handbook of Coherent-Domain Optical Methods, 857 –888 Springer, New York (2013). Google Scholar
7. F. Vasefi et al., « Imagerie hyperspectrale sensible à la polarisation in vivo: un dermoscope multimode pour l’analyse cutanée », Sci. Rép., 4 4924 (2014). https://doi.org/10.1038/srep04924 SRCEC3 2045-2322 Google Scholar
8. T. Yasui, Y. Tohno et T. Araki, « Détermination de l’orientation des fibres de collagène dans les tissus humains à l’aide de la mesure de la polarisation de la lumière moléculaire de deuxième génération harmonique », Appl. Opt., 43 (14), 2861 – 2867 (2004). https://doi.org/10.1364/AO.43.002861 APOPAI 0003-6935 Google Scholar
9. SRP Pavani, JG DeLuca et R. Piestun, « Imagerie à molécule unique tridimensionnelle sensible à la polarisation de cellules avec un système à double hélice », Opt. Express, 17 (22), 19644 -19655 (2009). https://doi.org/10.1364/OE.17.019644 OPEXFF 1094-4087 Google Scholar
10. DH Goldstein, Lumière polarisée, presse CRC, Boca Raton (2016). Google Scholar
11. N. Agarwal et al., « Évolution spatiale de la dépolarisation en milieu trouble homogène au sein du formalisme de matrice différentielle de Mueller », Opt. Lett., 40 (23), 5634 à 5637 (2015). https://doi.org/10.1364/OL.40.005634 OPLEDP 0146-9592 Google Scholar
12. O. Angelsky et al., « Etude de la structure matricielle de Mueller 2D de tissus biologiques pour le diagnostic préclinique de leurs états pathologiques », J. Phys. D: Appl. Phys., 38 (23), 4227 (2005). https://doi.org/10.1088/0022-3727/38/23/014 JPAPBE 0022-3727 Google Scholar
13. NK Das et al., « Évaluation quantitative de l’anisotropie à l’échelle submicronique dans la multifractalité tissulaire par diffusion de la matrice de Mueller dans le cadre de l’approximation de Born », Opt. Commun., 413 172-178 (2018). https://doi.org/10.1016/j.optcom.2017.11.082 OPCOB8 0030-4018 Google Scholar
14. M. Sun et al., « Caractérisation des microstructures des tissus biologiques à l’aide de la matrice de Mueller et des paramètres de polarisation transformés », Biomed. Opter. Express, 5 (12), 4223 à 4234 (2014). https://doi.org/10.1364/BOE.5.004223 BOEICL 2156-7085 Google Scholar
15. E. Du et al., « Polarimétrie matricielle de Mueller pour différencier les caractéristiques des tissus cancéreux », J. Biomed. Opt., 19 (7), 076013 (2014). https://doi.org/10.1117/1.JBO.19.7.076013 JBOPFO 1083-3668 Google Scholar
16. A. Pierangelo et al., « Caractérisation ex-vivo du cancer du côlon humain par imagerie polarimétrique Mueller », Opt. Express, 19 (2), 1582-1593 (2011). https://doi.org/10.1364/OE.19.001582 OPEXFF 1094-4087 Google Scholar
17. J. Rehbinder et al., « Imagerie polarimétrique ex vivo Mueller du col utérin: une première évaluation statistique », J. Biomed. Opt., 21 (7), 071113 (2016). https://doi.org/10.1117/1.JBO.21.7.071113 JBOPFO 1083-3668 Google Scholar
18. M. Borovkova et al., « Analyse complémentaire d’images à matrice de Mueller de tissus biologiques optiquement anisotropes hautement diffusants », J. Eur. Opter. Soc.-Rapid, 14 (1), 20 (2018). https://doi.org/10.1186/s41476-018-0085-9 Google Scholar
19. N. Ghosh, MF Wood et IA Vitkin, « Décomposition de la matrice de Mueller pour l’extraction de paramètres de polarisation individuels à partir de milieux turbides complexes présentant une diffusion multiple, une activité optique et une biréfringence linéaire », J. Biomed. Opt., 13 (4), 044036 (2008). https://doi.org/10.1117/1.2960934 JBOPFO 1083-3668 Google Scholar
20. S. Alali, Y. Wang et IA Vitkin, « Détection de l’hétérogénéité axiale de la biréfringence dans un milieu trouble en couches à l’aide de l’imagerie en lumière polarisée », Biomed. Opter. Express, 3 (12), 3250 – 3263 (2012). https://doi.org/10.1364/BOE.3.003250 BOEICL 2156-7085 Google Scholar
21. M. Ahmad et al., « Différents milieux troubles avec des propriétés optiques apparentes correspondantes présentent-ils également des propriétés de polarisation similaires? », Biomed. Opter. Express, 2 (12), 3248-3258 (2011). https://doi.org/10.1364/BOE.2.003248 BOEICL 2156-7085 Google Scholar
22. B. Kunnen et al., « Application de la lumière à polarisation circulaire pour le diagnostic non invasif des tissus cancéreux et des milieux de diffusion de type tissu trouble », J. Biophotonics, 8 (4), 317 -323 (2015). https://doi.org/10.1002/jbio.201400104 Google Scholar
23. C. Macdonald et I. Meglinski, « Rétrodiffusion de la lumière polarisée circulaire à partir d’un milieu aléatoire dispersé influencé par la compensation optique », Laser Phys. Lett., 8 (4), 324 (2011). https://doi.org/10.1002/lapl.201010133 1612-2011 Google Scholar
24. E. Avci, C. Macdonald et I. Meglinski, « Hélicité de la lumière polarisée circulaire rétrodiffusée à partir des tissus biologiques influencée par la compensation optique », Proc. SPIE, 8337 833703 (2012). https://doi.org/10.1117/12.923731 Google Scholar
25. M. Borovkova et al., « Influence de la diffusion et de la biréfringence sur le déphasage entre les composantes du champ électrique de la lumière polarisée propagée à travers les tissus biologiques », Proc. SPIE, 11075 110750R (2019). https://doi.org/10.1117/12.2526394 PSISDG 0277-786X Google Scholar
26. I. Meglinski et al., « Dépistage de l’agressivité du cancer en utilisant une lumière polarisée circulairement », Dans Opt. in the Life Sci., OSA Technical Digest (en ligne), BM2A.4 (2013). Google Scholar
27. I. Meglinski et al., « La cartographie des propriétés de diffusion des tissus sur la sphère de Poincaré », Dans Biomed. Opt., Résumé technique OSA, BW3B.6 (2012). Google Scholar
28. SL Jacques, « Propriétés optiques des tissus biologiques: un examen », Phys. Med. Biol., 58 R37-R61 (2013). https://doi.org/10.1088/0031-9155/58/11/R37 PHMBA7 0031-9155 Google Scholar
29. S. Alali et IA Vitkin, « Imagerie en lumière polarisée en biomédecine: nouvelles méthodologies matricielles de Mueller pour l’évaluation des tissus en vrac », J. Biomed. Opt., 20 (6), 061104 (2015). https://doi.org/10.1117/1.JBO.20.6.061104 JBOPFO 1083-3668 Google Scholar
30. JC Mansfield et al., « Disposition des fibres de collagène dans le cartilage normal et malade étudié par microscopie non linéaire sensible à la polarisation », J. Biomed. Opt., 13 (4), 044020 (2008). https://doi.org/10.1117/1.2950318 JBOPFO 1083-3668 Google Scholar
31. JF De Boer et al., « Imagerie bidimensionnelle de biréfringence dans les tissus biologiques par tomographie par cohérence optique sensible à la polarisation », Opt. Lett., 22 (12), 934 à 936 (1997). https://doi.org/10.1364/OL.22.000934 OPLEDP 0146-9592 Google Scholar
32. SH Hussain, B. Limthongkul et TR Humphreys, « Les propriétés biomécaniques de la peau », Dermatolog. Surg., 39 (2), 193 à 203 (2013). https://doi.org/10.1111/dsu.12095 Google Scholar
33. X. Feng, R. Patel et AN Yaroslavsky, « Imagerie grand champ à polarisation croisée optimisée en longueur d’onde pour une évaluation non invasive et rapide des structures dermiques », J. Biophotonics, 8 (4), 324 – 331 (2015). https://doi.org/10.1002/jbio.201400105 Google Scholar
34. F. MacKintosh et al., « Mémoire de polarisation de la lumière diffusée à plusieurs reprises », Phys. Rev. B, 40 (13), 9342 (1989). https://doi.org/10.1103/PhysRevB.40.9342 Google Scholar
35. M. Xu et R. Alfano, « Mémoire de polarisation circulaire de la lumière », Phys. Rev. E, 72 (6), 065601 (2005). https://doi.org/10.1103/PhysRevE.72.065601 Google Scholar
36. V. Kuzmin et I. Meglinski, « Helicity Flip de la lumière polarisée circulaire rétrodiffusée », Proc. SPIE, 7573 75730Z (2010). https://doi.org/10.1117/12.841193 Google Scholar
37. D. Bicout et al., « Dépolarisation d’ondes à diffusion multiple par diffuseurs sphériques: influence du paramètre de taille », Phys. Rev. E, 49 (2), 1767 (1994). https://doi.org/10.1103/PhysRevE.49.1767 Google Scholar
38. YL Kim et al., « Effet mémoire de polarisation circulaire dans la rétrodiffusion améliorée de la lumière à faible cohérence », Opt. Lett., 31 (18), 2744-2746 (2006). https://doi.org/10.1364/OL.31.002744 OPLEDP 0146-9592 Google Scholar
39. JF Ribeiro et al., « Ordre moléculaire des fibres de collagène cutané: un modèle d’orientation des fibres de distribution, tel qu’évalué par anisotropie optique et analyse d’image », PLoS One, 8 (1), e54724 (2013). https://doi.org/10.1371/journal.pone.0054724 POLNCL 1932-6203 Google Scholar
40. VV Tuchin, « Optique tissulaire: méthodes et instruments de diffusion de la lumière pour le diagnostic médical », SPIE Press, Bellingham, Washington (2007). Google Scholar
41. M. Ferraro et al., « Observation de la propagation de la lumière avec maintien de la polarisation dans les ferroélectriques dépolés à composition désordonnée », Opt. Lett., 42 3856 – 3859 (2017). https://doi.org/10.1364/OL.42.003856 OPLEDP 0146-9592 Google Scholar
42. MS Wróbel et al., « Utilisation de fantômes cutanés optiques pour l’évaluation préclinique de l’efficacité du laser pour le traitement des lésions cutanées », J. Biomed. Opt., 20 (8), 085003 (2015). https://doi.org/10.1117/1.JBO.20.8.085003 JBOPFO 1083-3668 Google Scholar
43. MS Wróbel et al., « Mesures des propriétés fondamentales des fantômes tissulaires homogènes », J. Biomed. Opt., 20 (4), 045004 (2015). https://doi.org/10.1117/1.JBO.20.4.045004 JBOPFO 1083-3668 Google Scholar
44. SA Prahl, MJ van Gemert et AJ Welch, « Détermination des propriétés optiques des milieux troubles à l’aide de la méthode d’addition-doublement », Appl. Opt., 32 (4), 559-568 (1993). https://doi.org/10.1364/AO.32.000559 APOPAI 0003-6935 Google Scholar
45. V. Tuchin, « Nettoyage optique des tissus et du sang à l’aide de la méthode d’immersion », J. Phys. D Appl. Phys., 38 (15), 2497 (2005). https://doi.org/10.1088/0022-3727/38/15/001 Google Scholar
46. X. Wen et al., « Clairance optique cutanée in vivo par des solutions de glycérol: mécanisme », J. Biophotonics, 3 (1–2), 44–52 (2010). https://doi.org/10.1002/jbio.200910080 Google Scholar
47. A. Doronin, C. Macdonald et IV Meglinski, « Propagation de lumière polarisée cohérente dans un milieu trouble hautement diffusant », J. Biomed. Opt., 19 (2), 025005 (2014). https://doi.org/10.1117/1.JBO.19.2.025005 JBOPFO 1083-3668 Google Scholar
48. W. Cai et al., « La solution cumulative analytique de l’équation de transfert radiatif vectoriel étudie la rétrodiffusion de la lumière polarisée de manière circulaire à partir d’un milieu trouble », Phys. Rev. E, 74 (5), 056605 (2006). https://doi.org/10.1103/PhysRevE.74.056605 Google Scholar
49. KG Phillips et al., « Structure en anneau résolue dans le temps de faisceaux polarisés circulairement rétrodiffusés à partir d’un milieu de diffusion vers l’avant », Opt. Express, 13 (20), 7954 à 7969 (2005). https://doi.org/10.1364/OPEX.13.007954 OPEXFF 1094-4087 Google Scholar
50. V. Kuzmin et I. Meglinski, « Effets de polarisation anormaux lors de la diffusion de la lumière dans un milieu aléatoire », J. Exp. Theor. Phys., 110 (5), 742 – 753 (2010). https://doi.org/10.1134/S1063776110050031 JTPHES 1063-7761 Google Scholar
51. A. Bykov et al., « Imagerie de l’os sous-chondral par tomographie par cohérence optique lors du dégagement optique du cartilage articulaire », J. Biophotonics, 9 (3), 270-275 (2016). https://doi.org/10.1002/jbio.201500130 Google Scholar
52. I. Meglinski et al., « Étude de la possibilité d’augmenter la profondeur de sondage par la méthode de microscopie confocale à réflexion lors du nettoyage par immersion de couches de peau humaine proches de la surface , ”Quantum Electron., 32 (10), 875 -882 (2002). https://doi.org/10.1070/QE2002v032n10ABEH002309 QUELEZ 1063-7818 Google Scholar
53. A. Doronin et I. Meglinski, « Outil de calcul Monte Carlo orienté objet en ligne pour les besoins de l’optique biomédicale », Biomed. Opter. Express, 2 (9), 2461 – 2469 (2011). https://doi.org/10.1364/BOE.2.002461 BOEICL 2156-7085 Google Scholar
54. I. Meglinski et VL Kuzmin, « Rétrodiffusion cohérente de la lumière polarisée circulairement à partir d’un milieu aléatoire dispersé », PIER M, 16 47 –61 (2011). https://doi.org/10.2528/PIERM10102106 Google Scholar
55. CM Macdonald, SL Jacques et I. Meglinski, « Mémoire de polarisation circulaire dans des milieux de diffusion polydispersés », Phys. Rev. E, 91 (3), 033204 (2015). https://doi.org/10.1103/PhysRevE.91.033204 Google Scholar
Biographie
Mariia Borovkova est doctorante à l’Université d’Oulu dans le cadre du programme doctoral I4Future dans le cadre de la bourse Marie Skłodowska-Curie. Elle a obtenu son BS en photonique de l’Université ITMO (Saint-Pétersbourg, Russie) en 2014. Elle a obtenu une maîtrise en optique de l’Université de Rochester, Rochester, New York, États-Unis et une maîtrise en photonique de l’Université ITMO en 2016. Ses intérêts de recherche portent sur l’imagerie par polarisation et spectroscopique pour le diagnostic biomédical. Elle est membre de SPIE.
Alexandre Bykov est professeur adjoint et chef de groupe de biophotonique au sein de l’Unité d’Optoélectronique et Techniques de Mesure de l’Université d’Oulu, Finlande. Il a obtenu son doctorat de l’Université d’État Lomonosov de Moscou, en Russie, et son diplôme DSc (Tech.) De l’Université d’Oulu en 2010. Il est auteur et coauteur de plus de 100 articles dans des revues scientifiques à comité de lecture. Ses intérêts scientifiques sont dans le domaine du diagnostic optique non invasif, y compris la polarisation et l’imagerie hyperspectrale.
Alexey Popov est professeur de recherche au Centre de recherche technique VTT de Finlande. Son activité scientifique couvre la photonique et la nanotechnologie, en se concentrant sur le développement de capteurs optiques et de modalités de diagnostic biomédical, la qualité des produits agricoles et les conditions environnementales, la protection UV, la détection de gaz et la photocatalyse.
Igor Meglinski est professeur à l’Université d’Oulu (Finlande) et à l’Université Aston (Royaume-Uni). Ses intérêts de recherche se situent à l’interface entre la physique et les sciences de la vie, se concentrant sur le développement de nouvelles techniques de diagnostic d’imagerie non invasive en médecine, en biologie, en sciences alimentaires, en surveillance environnementale et en soins de santé. Il est physicien agréé (CPhys), ingénieur agréé (CEng), membre senior de l’IEEE, membre de l’Institut de physique (FInstP) et membre de SPIE. © The Authors. Publié par SPIE sous une licence Creative Commons Attribution 4.0 Unported. La distribution ou la reproduction de cet ouvrage en tout ou en partie nécessite l’attribution complète de la publication originale, y compris son DOI. Citation Télécharger la citation Mariia A. Borovkova , Alexandre V. Bykov , Alexey Popov , et Igor V. Meglinski « Rôle de la diffusion et de la biréfringence dans le retard de phase révélé par le locus du vecteur de Stokes sur la sphère de Poincaré, » Journal de l’optique biomédicale 25 (5), 057001 (20 mai 2020). https://doi.org/10.1117/1.JBO.25.5.057001 Reçu: 22 octobre 2019; Accepté: 27 avril 2020; Publié: 20 mai 2020